*仅供医学专业人士阅读参考
癌症转移至今还是医学界的一大难题。纵观全球病例,癌症的远端转移是90%癌症患者的死亡原因。
理论上来说,脱离原发瘤、去往远端转移位置的“流浪癌细胞”应该更好杀死,因为它们脱离了原发瘤塑造的免疫抑制微环境,免疫系统应该更容易识别和杀死它们。但因着不明原因,还是有漏网之鱼能够逃脱免疫系统的天罗地网,埋下癌症转移的种子。
谁能想到呢,那个打压T细胞、使它们不能尽职干掉癌细胞的反派,竟然会是血小板?
今日,剑桥大学科研团队在《自然》杂志发表论文,研究者们发现,血小板衍生的血栓素A2(TXA2)会作用于T细胞受体,通过依赖Rho鸟嘌呤交换因子1(ARHGEF1)的免疫抑制途径抑制T细胞效应功能。
巧的是,在抗癌领域颇有威名的常用药阿司匹林,刚好是血小板分泌TXA2的抑制剂,也就意味着我们找到了一条阿司匹林抑制癌症转移的新机制通路。

论文题图
说起来,阿司匹林的出现还真完全是个意外。
起先,科学家们只是想要寻找在癌症转移过程中发挥主要作用的分子机制,以便对症下药、对抗转移。他们之前开展过一项研究,对小鼠的810个基因进行了大规模的体内遗传学筛选,发现了15个对癌症转移有影响的基因。
通过基因工程分别敲除小鼠中的这15个基因,再给小鼠注射B16黑色素瘤细胞,研究者发现,缺失Arhgef1的小鼠肺部转移数量显著减少。用LL/2肺癌细胞再次实验,也能观察到同样的结果。
此外,研究者还测试了MMTV-PyMT突变的自发性乳腺癌小鼠和MC38结直肠癌异种移植小鼠,虽然程度有所不同,但都能观察到Arhgef1缺失对癌症转移的抑制作用。
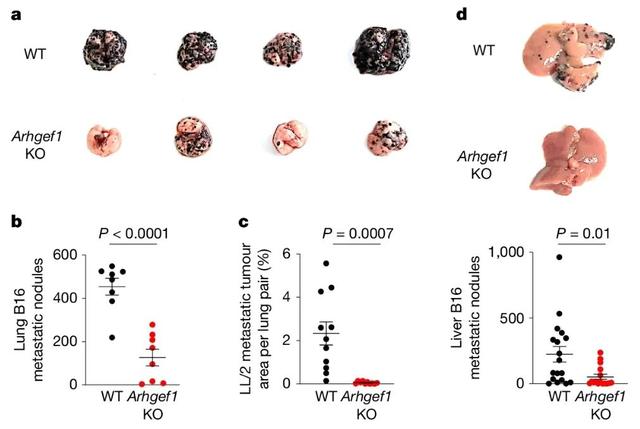
敲除Arhgef1显著减少了小鼠肺/肝的癌转移
ARHGEF1主要在造血谱系细胞中表达。研究者依次测试了各种造血谱系细胞,发现T细胞的功能有显著不同。Arhgef1缺失T细胞,IFNγ等细胞因子分泌显著增加、PD-1等耗竭标志物表达降低,抗肿瘤免疫功能显著增强。
为了寻找背后机制,研究者分析了T细胞中ARHGEF1上下游的受体和配体。ARHGEF1可被G蛋白偶联受体(GPCR)激活,进而激活GTP酶RhoA启动细胞内信号转导。
筛选能与ARHGEF1相互作用的GPCR,研究者们有了一个惊奇的发现,完全依赖于ARHGEF1起到抑制T细胞作用的GPCR,指向的U46619,是一种TXA2类似物。
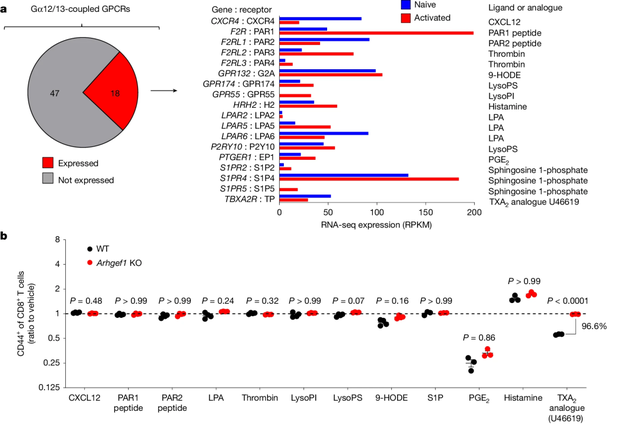
ARHGEF1作用的GPCR筛选
研究者几乎是立刻就想到阿司匹林了。
TXA2是一种循环中的血小板产生分泌的凝血因子,可帮助血液凝结、防止伤口出血,但也与卒中和心脏病发作有关。TXA2的产生依赖血小板表达的环氧化酶(COX),COX抑制剂阿司匹林的抗凝血作用,正是通过减少TXA2产生实现的。
逆推一下,阿司匹林完全有希望成为癌症转移的“刹车”!
实验结果可见,用阿司匹林治疗黑色素瘤小鼠可显著降低癌症转移频率,小鼠血清中TXA2代谢物水平显著降低。
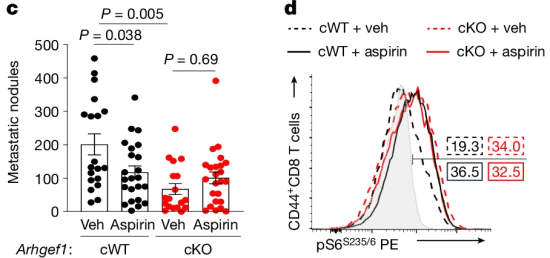
阿司匹林可显著减少小鼠癌转移频率
已有不少大型随机对照试验的荟萃分析结果显示,阿司匹林与多种癌症发生/转移风险降低有关,本研究为阿司匹林抗癌再添力证。但阿司匹林作用有一定剂量效应,到底如何给药才能起到理想的临床效果,在有大规模试验探索之前,我们还无法确定。


参考资料:
[1]Yang, J., Yamashita-Kanemaru, Y., Morris, B.I. et al. Aspirin prevents metastasis by limiting platelet TXA2 suppression of T cell immunity. Nature (2025). https://doi.org/10.1038/s41586-025-08626-7


本文作者丨代丝雨
评论列表 (0条)